IntroducciónEl hipertiroidismo es un trastorno patológico en el que se sintetiza un exceso de hormona tiroidea secretada por la glándula tiroides. Se caracteriza por una captación tiroidea normal o elevada de yodo radiactivo (tirotoxicosis con hipertiroidismo o hipertiroidismo verdadero). La tirotoxicosis sin hipertiroidismo se origina en fuentes extratiroideas de hormona tiroidea o por la liberación de hormonas tiroideas preformadas en la circulación, con descenso de la captación de yodo radiactivo por la glándula tiroides.
| Mecanismos patogenéticos de las causas de tirotoxicosis |
| Tirotoxicosis con hipertiroidismo (captación de yodo radiactivo normal o elevada) |
| Efecto aumentado de estimuladores tiroideos | |
| Anticuerpo receptor de TSH | Enfermedad de Graves |
| Secreción inapropiada de TSH | Adenoma hipofisario secretor de TSH; resistencia hipofisaria a la hormona tiroidea |
| Exceso de secreción de GH | Tumores trofoblásticos (coriocarcinoma y mola hidatiforme); hiperemesis gravídica |
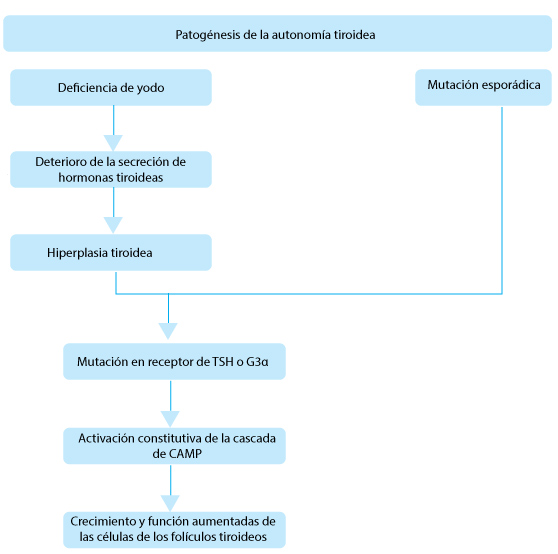
| Función tiroidea autónoma | |
| Activación de mutaciones del receptor de TSH o de la proteína G3α. | Adenoma hiperfuncionante solitario; bocio multinodular; hipertiroidismo familiar no autoinmune
Tirotoxicosis sin hipertiroidismo (captación de yodo radioactivo baja) |
| Tirotoxicosis sin hipertiroidismo (captación de yodo radioactivo baja) |
| Inflamación/liberación de hormona almacenada | |
| Destrucción autoinmune de la gl. tiroides | Tiroiditis silente (indolora); tiroiditis posparto |
| Infección viral* | Tiroiditis subaguda (dolorosa) (tiroiditis de De Quervain) |
| Efecto tóxico de los fármacos | Tiroiditis inducida por fármacos (amiodarona,, litio, interferón α) |
| Infección bacteriana o fúngica | Tiroiditis supurativa aguda |
| Radiación | Tiroiditis por radiación |
| Origen hormonal extratiroiedeo | Exceso exógeno (iatrogénico o facticio) |
| Exceso de captación de la hormona tiroidea | Struma ovarii; metástasis funcionante de cáncer de tiroides |
| Hipertiroidismo ectópico (producción extratiroidea de hormona tiroidea) | |
| Ingestión de alimentos contaminados | Tiroiditis de Hamburger |
| Exposición al exceso de yodo | |
| Efecto Jod-Basedow | Hipertiroidismo inducido por yodo (yodo, medicamentos que contienen yodo, agentes de contraste radiográfico) |
El hipertiroidismo puede ser manifiesto o subclínico. El hipertiroidismo manifiesto se caracteriza por un descenso de la concentración de hormona estimulante de la tiroides (TSH) en el suero y un aumento de las concentraciones séricas de las hormonas tiroideas: tiroxina (T4), triyodotironina (T3), o ambos. El hipertiroidismo subclínico se caracteriza por una disminución de los valores de la TSH, pero con concentraciones séricas de T4, y T3 normales.
Epidemiología
La prevalencia de hipertiroidismo es 0, 8% en Europa y 1, 3% en EE. UU. El hipertiroidismo aumenta con la edad y es más frecuente en las mujeres. La prevalencia del hipertiroidismo manifiesto es 0, 5-0,8% en Europa y 0, 5% en EE. UU. Los datos sobre diferencias étnicas son escasos, pero parece ser ligeramente más frecuentes en las personas de raza blanca que en otras razas. La incidencia de hipertiroidismo leve también es mayor en ciertas zonas con deficiencia de yodo, pero ha disminuido después de la aplicación de los programas de yodación universal de la sal.
Etiología
► Tirotoxicosis con hipertiroidismo
La causa más común de hipertiroidismo en las zonas deficientes de yodo es la enfermedad de Graves. En Suecia, la incidencia anual es cada vez mayor, con 15-30 casos nuevos/100.000 habitantes en la década del 2000. Se cree que la causa de la enfermedad de Graves es multifactorial, originada en la pérdida de la inmunotolerancia y el desarrollo de autoanticuerpos que estimulan las células foliculares tiroideas por unión al receptor de TSH. Varios estudios han proporcionado alguna evidencia de la existencia de una predisposición genética a la enfermedad de Graves; sin embargo, la tasa de concordancia en los gemelos monocigotas es solo 17-35%, lo que sugiere una penetrancia baja.
Los genes implicados en la enfermedad de Graves son genes inmunorreguladores (región HLA, CD40, CTLA4, PTPN22 y FCRL3) y autoantígenos de la tiroides como los genes de tiroglobulina y del receptor de TSH. Los factores de riesgo no genéticos para el desarrollo de la enfermedad de Graves incluyen el estrés psicológico, el tabaquismo y el sexo femenino. Dada la mayor prevalencia de la enfermedad en las mujeres, se sospecha que las hormonas sexuales y los factores cromosómicos como así la inactivación sesgada del cromosoma X, son factores desencadenantes.
Otros factores también que también pueden actuar como desencadenantes son la infección (especialmente por Yersinia enterocolitica, debido a un mecanismo de mimetismo molecular con el receptor de TSH), la deficiencia de vitamina D y selenio, el daño tiroideo y los fármacos inmunomoduladores. Se requieren más estudios para determinar mejor el papel de estos factores como causantes de la enfermedad de Graves.
Otras causas comunes de hipertiroidismo son el bocio multinodular tóxico y el adenoma solitario. A pesar de que en las zonas deficientes yodo casi el 80% de los pacientes hipertiroideos padece la enfermedad de Graves, el bocio multinodular tóxico y el adenoma tóxico son responsables del 50% de todos los casos de hipertiroidismo, con mayor predominancia en la edad avanzada. Los nódulos tiroideos se tornan autónomos y producen hormonas tiroideas que son independientes de las señales de la TSH o de los anticuerpos de los receptores de TSH.
Las causas menos comunes de hipertiroidismo son la toxicosis inducida por tirotrofina y los tumores trofoblásticos, en los cuales los receptores de TSH son estimulados por el exceso de TSH y gonadotrofina coriónica humana, respectivamente.
► Tirotoxicosis sin hipertiroidismo
Estas causas de tirotoxicosis son menos comunes y generalmente transitorias. En los pacientes con tiroiditis silenciosa, tiroiditis postparto o tiroiditis subaguda dolorosa, la destrucción de los tirocitos conduce a la liberación de hormona tiroidea preformada a la circulación. La tirotoxicosis inducida por fármacos tiene el mismo mecanismo patogénico que la tiroiditis. El litio, el interferón α y la amiodarona con frecuencia están implicados en la disfunción tiroidea inducida por fármacos.
La tirotoxicosis facticia es exógena o iatrogénica, se desarrolla después de la ingestión de cantidades excesivas de hormonas tiroideas y se asocia con una concentración baja de tiroglobulina sérica. El hipertiroidismo ectópico es extremadamente raro, incluyendo las metástasis del cáncer de tiroides y del struma ovárii, un tumor del ovario que contiene tejido tiroideo funcionante.
Presentación clínica y complicaciones
► Signos y síntomas por exceso de hormonas tiroideas
El exceso de hormonas tiroideas afecta a muchos órganos diferentes. Los síntomas más frecuentes son: palpitaciones, fatiga, temblor, ansiedad, trastornos del sueño, pérdida de peso, intolerancia al calor, sudoración y polidipsia. Los hallazgos físicos frecuentes son: taquicardia, temblor de las extremidades y adelgazamiento.
► Signos y síntomas relacionados con las causas subyacentes de hipertiroidismo
Los signos y síntomas incluyen: oftalmopatía, dermopatía tiroidea y acropaquia de la enfermedad de Graves; sensación de globo, disfagia u ortopnea debida a la compresión esofágica o traqueal por el bocio nodular; dolor de cuello anterior en la tiroiditis subaguda dolorosa.
La oftalmopatía, también conocida como orbitopatía de Graves se produce en el 25% de los pacientes con enfermedad de Graves. Los signos principales son: proptosis, edema periorbitario y diplopía. Los médicos sin experiencia en el manejo de la orbitopatía de Graves activa o moderada a severa deben derivar a los pacientes a un ooftalmólogo especializado en la afección ocular de la enfermedad tiroidea para su evaluación y tratamiento.
La dermopatía tiroidea es una manifestación extratiroidea rara de la enfermedad de Graves que ocurre en el 1-4% de los pacientes con oftalmopatía tiroidea. En casi todos ellos coexiste la oftalmopatía. Las lesiones se caracterizan por el engrosamiento de la piel ligeramente pigmentada, que afecta principalmente a la zona pretibial.
La acropaquia es la manifestación extratiroidea más rara de la enfermedad de Graves y se presenta con dedos en palillo de tambor en las manos y los pies.
► Complicaciones observadas en el hipertiroidismo
La manifestación clínica varía dependiendo de varios factores, como la edad y el sexo del paciente, las comorbilidades, la duración de la enfermedad y la causa. Los pacientes mayores se presentan son oligosintomáticos, con síntomas menos pronunciados que los pacientes más jóvenes, pero son más propensos a desarrollar complicaciones cardiovasculares. Cuando se compara con las personas >60 años con una tiroides saludable, los hipertiroideos tienen 3 veces más riesgo de fibrilación auricular.
El
accidente cerebrovascular embólico relacionado con la fibrilación auricular secundaria al hipertiroidismo, es significativamente MÁS prevalente que la embolia cerebral relacionada con la fibrilación auricular de causas no tiroideas. Sin embargo, el tratamiento anticoagulante en los pacientes con fibrilación auricular secundaria al hipertiroidismo sigue siendo tema de debate. También se piensa que la fibrilación auricular es un predictor independiente de desarrollar insuficiencia cardíaca congestiva en los pacientes con hipertiroidismo. Se ha informado un riesgo mayor de mortalidad global en los pacientes con hipertiroidismo, siendo la causa principal la insuficiencia cardíaca.
Otra complicación grave asociada al hipertiroidismo es la
parálisis periódica tirotóxica. Es más frecuente en los pacientes asiáticos; su incidencia oscila entre el 0, 2% en América del Norte y el 2% en Japón. Se caracteriza por la tríada de:
- parálisis muscular
- hipopotasemia aguda
- tirotoxicosis
Está causada por un cambio de potasio en las células musculares. Las mutaciones en los canales de potasio, cuya transcripción está regulada por las hormonas tiroideas, podrían ser responsables de la enfermedad. Ante la sospecha de esta enfermedad se debe iniciar cuanto antes el tratamiento con dosis bajas de potasio y bloqueantes ß no selectivos, para prevenir las arritmias y restaurar la función muscular.
Otras complicaciones de la tirotoxicosis de larga data son la osteoporosis y las anomalías del sistema reproductivo, como la ginecomastia en los hombres y la disminución de la fertilidad e irregularidades menstruales en las mujeres.
Diagnóstico
Inicialmente se debe determinar la TSH sérica, porque tiene la mayor sensibilidad y especificidad para el diagnóstico de los trastornos tiroideos. Si las concentraciones séricas de T4 libre o el índice de T4 libre están bajos se debe medir la concentración de T3 libre total, con el fin de distinguir entre el hipertiroidismo subclínico (con hormonas circulantes normales) y el hipertiroidismo manifiesto (con hormonas tiroideas elevadas).
También identifican a los trastornos con concentraciones de hormona tiroidea aumentadas y normales o solamente con concentraciones de TSH levemente aumentadas, como en los pacientes con adenomas hipofisarios secretores de TSH o con resistencia periférica a la hormona tiroidea.
La modalidad preferida para evaluar la causa de las tirotoxicosis varía mucho. Las diferentes características de la población, los antecedentes culturales y las razones socioeconómicas explican en parte estas diferencias. Las guías de la American Thyroid Association (ATA) y la American Association of Clinical Endocrilologists (AACE) para el hipertiroidismo y la tirotoxicosis recomiendan una prueba de la captación de yodo radiactivo de la tiroides, para los casos en los que no se ha podido establecer clínicamente el diagnóstico de enfermedad de Graves. En Europa, Japón y Corea se prefiere utilizar la ecografía tiroidea y la evaluación de los anticuerpos anti-receptor de TSH (TRAb, es decir, la inmunoglobulina estimulante del tiroides o los anticuerpos tiroideo estimulantes).
Las guías de EE. UU. consideran la medición de los TRAb como una forma alternativa para el diagnóstico de la enfermedad de Graves, especialmente cuando la captación de yodo radiactivo no está disponible o está contraindicada. Esta recomendación es compartida por el Consenso Brasileño de tiroides que tiene en cuenta las pruebas útiles de TRAb solo en casos seleccionados, mientras que para la evaluación inicial de la tirotoxicosis prefieren la captación de yodo radiactivo. En su práctica clínica, los autores siguen el enfoque europeo y de sus colegas asiáticos, utilizando la ecografía y las mediciones de los TRAb.
En los pacientes con enfermedad de Graves, la prueba de captación tiroidea de yodo radiactivo mostraría un aumento difuso de la captación. En cambio, en el bocio nodular tóxico la captación de yodo radiactivo sería normal o elevada con un patrón asimétrico e irregular; en el bocio multinodular se observaría una mayor captación localizada y focal, con una captación suprimida del tejido tiroideo restante. En los pacientes con tirotoxicosis por un origen extratiroideo de hormona tiroides o por liberación de hormonas tiroideas preformadas, como en la tiroiditis silente o dolorosa, la captación de yodo radiactivo en será muy baja.
La ecografía tiroidea y la captación tiroidea de yodo radioactivo tienen una sensibilidad similar para el diagnóstico de la enfermedad de Graves (2% y 97,4%, respectivamente). Las ventajas de la ecografía son la ausencia de exposición a la radiación ionizante y una mayor precisión en la detección de los nódulos tiroideos, con un costo más bajo que la captación de yodo radiactivo.
Por otra parte, el eco Doppler de flujo color permite diferencias la enfermedad de Graves (aumento del flujo sanguíneo, hipoecogénica y difusamente agrandada) de la tirotoxicosis inducida por la destrucción tisular (disminución del flujo sanguíneo). Las diferencias en el enfoque entre los endocrinólogos europeos y los americanos podrían resultar de la diferente epidemiología del hipertiroidismo, porque el bocio nodular es la causa predominante de hipertiroidismo en muchas zonas de Europa.
En los últimos años, los ensayos de TRAb se han vuelto más confiables y menos costosos. Por otra parte, las mediciones de TRAb son útiles para predecir cuáles son los pacientes con riesgo de recaída después de la interrupción de los fármacos antitiroideos, y para detectar la tirotoxicosis fetal o neonatal en las mujeres con enfermedad de Graves, ya que estos anticuerpos atraviesan fácilmente la placenta.
Tratamiento
Las 3 opciones para el tratamiento de los pacientes con hipertiroidismo son: los fármacos antitiroideos (ATD), la ablación con yodo radiactivo y la cirugía. Las 3 opciones terapéuticas son efectivas para el tratamiento de los pacientes con enfermedad de Graves, mientras que los pacientes con adenoma tóxico o bocio multinodular tóxico deben ser sometidos a la terapia radiactiva con yodo o a la cirugía, ya que rara vez la enfermedad remite. En los pacientes con bocio nodular tóxico, los ATD se utilizan generalmente para restaurar el eutiroidismo previo al tratamiento definitivo con cirugía o yodo radiactivo; en pocos casos se usan como tratamiento a largo plazo, cuando las otras dos terapias están contraindicadas o el paciente tiene una expectativa de vida corta.
La elección del tratamiento para la enfermedad de Graves depende de las regiones geográficas. El tratamiento con yodo radioactivo se utiliza con frecuencia como terapia de primera línea en Norteamérica. Fuera de los EE.UU., como tratamiento inicial se prefieren los ATD, mientras que el tratamiento definitivo es se reserva solo para los pacientes con hipertiroidismo persistente o recurrente. Por otra parte, los pacientes pueden tomar bloqueantes ß para el alivio de los síntomas de hipertiroidismo.
Fármacos antitiroideos► Generalidades
Los fármacos antitiroideos del grupo de las tionamidas son el propiltiouracilo, el tiamazol y el carbimazol y son transportados activamente hacia la glándula tiroides donde inhiben la oxidación y organificación del yoduro mediante la inhibición de la peroxidasa tiroidea y el acoplamiento de las yodotirosinas para sintetizar T4 y T3. El carbimazol está disponible en algunos países de Europa y Asia; se convierte en el forma activa, el tiamazol, con propiedades similares al tiamazol. Las grandes dosis de propiltiouracilo, no así el tiamazol, disminuyen la conversión de T4 a T3 en los tejidos periféricos inhibiendo la deiodinasa del anillo exterior de T4. Estos fármacos también podrían tener efectos antiinflamatorios e inmunosupresores.
La guía de ATA/AACE recomienda al tiamazol como el medicamento de elección para la enfermedad de Graves. Las excepciones son el primer trimestre del embarazo y los pacientes con reacciones adversas al tiamazol. Este fármaco tiene varias ventajas sobre el propiltiouracilo, entre ellas su mayor eficacia; una vida media y una duración de la acción más largas, lo que permite dosificarlo 1 vez/día, y no 2-3 veces diarias como requiere el propiltiouracilo; además, tiene efectos secundarios no tan graves. Los informes de daño hepático en pacientes en tratamiento prolongado con propiltiouracilo llevaron a la ATA y la Food and Drug Administration de EE. UU. reevaluara el papel del propiltiouracilo en el tratamiento de la enfermedad de Graves, resultando en que no lo recomiendan como fármaco de primera línea. Aunque se ha sugerido el tratamiento precoz de ATD combinados con yoduro de potasio, en general, no este enfoque no es recomendado.
► Protocolos para la terapia con ATD y el seguimiento
Hay 2 enfoques para el tratamiento de la enfermedad de Graves: la titulación y, el bloqueo y reemplazo. Con la titulación, la dosis del ATD se valora durante el transcurso del tratamiento para elegir la dosis más baja necesaria que permita mantener un estado eutiroideo. En el régimen de bloqueo y reemplazo se utiliza una dosis mayor de ATD sumado al reemplazo concurrente con levotiroxina. Los dos regímenes son igualmente efectivos pero el bloqueo y reemplazo parece ir asociado con una mayor incidencia de efectos colaterales que la titulación. Por lo tanto, el enfoque de primera línea debe ser la titulación, aunque algunos autores consideran que ambos enfoques son igualmente seguros.
La dosis inicial de tiamazol depende de la gravedad del hipertiroidismo y del tamaño de la glándula tiroides: El hipertiroidismo leve y las glándulas pequeñas necesitan 10-15 mg de tiamazol diarios, y el hipertiroidismo grave y las glándulas tiroides grandes necesitan 20-40 mg/día. La dosis equivalente de carbimazol es el 140% de la dosis del tiamazol. La dosis inicial de propiltiouracilo es generalmente 50-150 mg y se administra 3 veces/día.
La función tiroidea debe ser verificada 4-6 semanas después del inicio del tratamiento y luego, una vez que el paciente está eutiroideo, cada 2-3 meses, aunque cuando el paciente este eutiroideo la frecuencia de las visitas médicas es cada 4 meses. La TSH podría permanecer suprimida durante varios meses, razón por la cual se debe monitorear la T4 y T3 para evaluar eficacia de la terapia. Una vez logrado el eutiroidismo, la dosis de mantenimiento es 5-10 mg de tiamazol/día o, 50 mg de propiltiouracilo, 2-3 veces/día o inferior, para continuar durante 12-18 meses; algunos sugieren una duración de la terapia aún más prolongada.
Un inconveniente de la terapia ATD es la elevada tasa de recaída de del hipertiroidismo después de haber descontinuado el fármaco. Las recaídas son más frecuentes durante el primer año que en los años posteriores, sobre todo en los primeros 6 meses después de suspender el medicamento, pero es poco frecuente después de 4-5 años. El riesgo de recurrencia varía enormemente entre los pacientes, pero se estima que es del 50-55%, según una revisión de Cochrane de 266 ensayos clínicos aleatorizados. Los pacientes con mayor riesgo de recurrencia son los que tienen hipertiroidismo grave, bocio grande, relación T3: T4 elevada, persistencia de la TSH suprimida y concentraciones elevadas de TRAb basal.
Las concentraciones de TRAb al final del tratamiento podrían ser útiles para identificar a los pacientes que sufren una recaída del hipertiroidismo después de la interrupción del tratamiento. Un estudio prospectivo sugiere que un segundo curso de fármacos del grupo tionamidas posterior a la recurrencia del hipertiroidismo puede provocar una remisión prolongada. Sin embargo, se necesitan más estudios para confirmar estos datos, y comparar la eficacia y los efectos colaterales del segundo curso del tratamiento con ATD, de la ablación con yodo radiactivo o de la cirugía.
► Efectos secundarios
Los efectos secundarios menores de los ATD ocurren en casi el 5% de los pacientes. Los efectos secundarios incluyen: prurito, artralgias y malestar gastrointestinal. En los pacientes con reacciones cutáneas de menor importancia se puede agregar un antihistamínico o puede sustituir un ATD por otro.
Los efectos secundarios importantes de los ATD son raros. La
agranulocitosis(recuento de granulocitos absoluto <500 células/mm³) es un efecto secundario que puede ser potencialmente mortal. Los pacientes suelen presentar fiebre o dolor de garganta, o ambos, y en ocasiones, otros síntomas menos comunes como escalofríos, diarrea y mialgias. La incidencia anual de agranulocitosis ha sido estimada en 0,1-0,3%, y ocurre generalmente dentro de los 90 días después del inicio de la terapia. Cuando los pacientes que reciben ATD presentan estos síntomas se debe hacer un recuento diferenciado de glóbulos blancos.
Si el recuento de granulocitos es <1.000 células/mm³ el ATD se debe suspender inmediatamente. También podría requerirse el tratamiento de la agranulocitosis y sus infecciones asociadas, con la administración de antibióticos de amplio espectro y el factor estimulante de colonias de granulocitos, que ha demostrado reducir el tiempo de recuperación. La prueba con otro ATD está contraindicada en esta circunstancia debido a la reacción cruzada entre el tiamazol y el propiltiouracilo. La guía de ATA/AACE sugiere hacer un hemograma completo de base a todos los pacientes antes de iniciar el tratamiento, pero no recomienda el monitoreo de rutina durante el curso terapéutico.
Esta práctica también es aceptada fuera de los EE.UU., excepto en Japón, donde se recomienda el control periódico de los leucocitos sanguíneos cada 2 semanas durante los primeros 2 meses de terapia. Los pacientes deben ser instruidos para que reconozcan los síntomas de agranulocitosis (fiebre o el dolor de garganta) ya que deben suspender el fármaco y ponerse en contacto con su médico tan pronto como sea posible. Una encuesta mostró la falta de conocimiento de este efecto colateral potencialmente grave en los pacientes que reciben ATD. Otros efectos secundarios hematológicos muy raros de los ATD son la anemia aplásica, la trombocitopenia y la hipoprotrombinemia.
Otro efecto secundario importante es la
hepatotoxicidad, que ocurre en el 0,1-0,2% de los pacientes. Generalmente se desarrolla dentro de los 3 meses de tratamiento con un pico de incidencia en los primeros 30 días. Las manifestaciones más comunes de la hepatotoxicidad en los pacientes que toman tiamazol o propiltiouracilo es la hepatitis.
La
hepatotoxicidad rara vez se puede presentar como insuficiencia hepática aguda, la cual se asocia con más frecuencia con el propiltiouracilo que con el tiamazol, y podría requerir el trasplante de hígado. La guía ATA/AACE recomienda obtener un perfil hepático sérico al inicio del estudio, pero no aprueba el seguimiento periódico a menos que el paciente se queje de síntomas de disfunción hepática, tales como erupción cutánea pruriginosa, ictericia, hippocolia o coluria. En los pacientes que toma tiamazol se puede producir colestasis, la que es infrecuente con el propiltiouracilo: los problemas hepáticos están principalmente relacionados con la necrosis hepatocelular.
La
vasculitis es una complicación muy rara que ha sido detectada durante el tratamiento con ATD. La vasculitis se suele acompañar de anticuerpos anticitoplasma de neutrófilos y es más frecuente en los pacientes que toman propiltiouracilo que en los que reciben tiamazol. Los pacientes pueden presentar fiebre, artralgias y alteraciones cutáneas, o pueden tener insuficiencia orgánica, principalmente renal y pulmonar.
Tratamiento con yodo radiactivo► Generalidades
La terapia con yodo radiactivo es segura y rentable, y puede ser el tratamiento de primera línea para la enfermedad de Graves, el adenoma tóxico y el bocio multinodular tóxico. Las contraindicaciones absolutas son el embarazo, la lactancia materna, la planificación de un embarazo y la incapacidad para cumplir con las recomendaciones de seguridad para la radiación. En los pacientes con nódulos tiroideos con histología sospechosa de cáncer de tiroides, el yodo radiactivo está contraindicado; en su lugar, está indicada la cirugía. Se ha demostrado que la terapia con yodo radiactivo es responsable del desarrollo de una orbitopatía de Graves de novo o del empeoramiento de una ya existente, aunque otros autores no coinciden con este concepto.
Un metaanálisis informó un aumento del riesgo de empeoramiento de la orbitopatía de Graves en los pacientes que recibieron tratamiento con yodo radiactivo comparados con aquellos que recibieron ATD, y un riesgo ligeramente mayor en comparación con la cirugía. Por lo tanto, la terapia con yodo radiactivo está contraindicada en los pacientes con orbitopatía de Graves moderada a grave o con peligro de pérdida de la visión. En los pacientes con orbitopatía de Graves activa leve, el tratamiento con yodo radiactivo debe ser seguido por el tratamiento profiláctico con esteroides (0,3-0,5 mg/kg de prednisona/día, comenzando después de 1-3 días del yodo radiactivo y disminuido a lo largo de 3 meses).
Los pacientes con orbitopatía de Graves inactiva pero sin factores de riesgo se pueden tratar con yodo radiactivo sin corticosteroides. Los factores de riesgo de desarrollar y empeorar la orbitopatía de Graves después de la terapia con yodo radioactivo incluye a los fumadores, las concentraciones elevadas de T3 pretratamiento (≥5 nmol/L), títulos elevados de TRAb e hipotiroidismo no tratado después del tratamiento con yodo radiactivo. Todavía se debate la necesidad de profilaxis con glucocorticoides en los pacientes con factores de riesgo pero con orbitopatía de Graves inactiva o no preexistente.
► Tratamiento de pacientes que recibieron yodo radiactivo
Algunos pacientes, especialmente los ancianos y las personas con comorbilidades (en particular con complicaciones cardiovasculares) o tirotoxicosis grave) pueden necesitar un tratamiento previo con ATD. La necesidad de tratamiento previo y el efecto de los ATD sobre la terapia con yodo radiactivo son discutibles. Algunos sostienen que el pretratamiento con tiamazol no tiene efecto sobre la eficacia de la terapia con yodo radiactivo, sino que tiene un efecto protector porque disminuye las concentraciones basales de hormona tiroidea antes de la terapia con yodo radioactivo. Otros sostienen que no protegen contra la exacerbación de la tirotoxicosis.
Un metaanálisis mostró que el pretratamiento con ATD aumenta el riesgo de fracaso terapéutico y reduce el riesgo de hipotiroidismo después del yodo radiactivo. Cuando antes de la terapia con yodo radiactivo se utiliza un ATD, el medicamento de elección es el tiamazol, ya que el propiltiouracilo ha sido relacionado con tasas más elevadas de fallo terapéutico. Los ATD deben suspenderse 3-5 días antes de la terapia con yodo radiactivo para reiniciarlos 3-7 días más tarde, retirándolos en cuanto se normaliza la función tiroidea.
La dosis óptima de yodo radiactivo se debate entre una dosis fija y una dosis calculada sobre la base de de la captación tiroideas del yodo radiactivo. Varios estudios no hallaron diferencias significativas en los resultados terapéuticos y en las tasas de hipotiroidismo permanente entre los dos regímenes. Cuando se utiliza la dosis fija para el tratamiento de la enfermedad de Graves se recomienda 15 mCi, y para el bocio nodular tóxico, 10-20 mCi.
► Seguimiento de los pacientes tratados con yodo radiactivo
Se debe supervisar la función tiroidea 1-2 meses después de la terapia con yodo radiactivo. Algunos sugieren la medición de la T4 libre a partir de las 6 semanas de la terapia con yodo radiactivo, para detectar el hipotiroidismo, especialmente en los pacientes con riesgo de desarrollar o empeorar la orbitopatía de Graves. Si 1-2 meses después de la terapia con yodo radiactivo el paciente está todavía tirotóxico, se debe monitorear la función tiroidea cada 4-6 semanas hasta que el paciente esté eutiroideo o hipotiroideo.
El reemplazo con levotiroxina debe ser iniciado tan pronto como se produce el hipotiroidismo. El monitoreo posterior es importante porque algunos pacientes que recibieron yodo radiactivo podrían tener hipotiroidismo transitorio seguido de una recaída del hipertiroidismo. Estos pacientes suelen ser más jóvenes, tienen bocios grandes y fueron tratados previamente con propiltiouracilo. Los pacientes con recaída del hipertiroidismo o hipertiroidismo persistente después de 6 meses pueden recibir yodo radiactivo de nuevo.
► Efectos secundarios
A excepción de la oftalmopatía, los efectos adversos del yodo radiactivo son raros y no están bien establecidos. Un efecto colateral es la tiroiditis aguda. Se produce en el 1% de los pacientes, dura unas pocos semanas y se trata fácilmente con fármacos antiinflamatorios no esteroideos (AINE), y bloqueantes ß para la exacerbación del hipertiroidismo asociado. Algunos pacientes graves pueden necesitar glucocorticoides. Se han postulado otros efectos adversos del tratamiento con yodo radiactivo, pero no se ha llegado a un consenso claro al respecto.
Se considera que hay mayor riesgo de enfermedades cardiovasculares y eventos cerebrovasculares pero no está claro si los eventos son causados por el hipertiroidismo en sí o por la terapia con yodo radiactivo. La incidencia de cáncer es ligeramente mayor en los pacientes con hipertiroidismo que en los pacientes eutiroideos, pero no tiene relación con el tipo de terapia tiroidea. Por último, las dosis más elevadas de yodo radiactivo, por lo general utilizado para el tratamiento del cáncer de tiroides, se asocian con el deterioro de la función gonadal, lo que no sucede con las dosis más bajas utilizadas para el hipertiroidismo. No se han informado efectos adversos sobre la salud de la descendencia fuera de los pacientes que recibieron yodo radiactivo para el hipertiroidismo antes del embarazo.
Tiroidectomía► Generalidades
La tiroidectomía es el tratamiento más exitoso para el hipertiroidismo de Graves. Se recomienda la tiroidectomía total porque la frecuencia de resultados exitosos es significativamente mayor que con la tiroidectomía subtotal, sin diferencias en la tasa de complicaciones. La tiroidectomía se recomienda especialmente para los pacientes con las siguientes características: los bocios grandes o la captación de yodo radiactivo baja (o ambas); el cáncer de tiroides sospechado o confirmado; la oftalmopatía moderada a grave, para los que la terapia con yodo radiactivo está contraindicada y, finalmente, la preferencia por la cirugía. Por el contrario, la tiroidectomía debe evitarse en los pacientes que no son buenos candidatos para la cirugía. Se considera que el embarazo solo es una contraindicación relativa.
► Manejo preoperatorio y seguimiento de los pacientes tiroidectomizados
Antes de la cirugía, los pacientes deben estar eutiroideos. El pretratamiento con ATD reduce el riesgo de tormenta tiroidea precipitada por la cirugía, y los bloqueantes ß para el control de los síntomas de hipertiroidismo. El pretratamiento con yoduro inorgánico, como el yoduro de potasio (50 mg de yoduro, 3 veces/día, durante 7-10 días antes de la cirugía) también puede ser considerado en los pacientes con enfermedad de Graves. El yoduro inorgánico reduce la liberación de hormona tiroidea y la vascularización de la glándula, lo que a su vez disminuye la pérdida de sangre intraoperatoria. Entre 6 y 8 semanas después de la cirugía Después de la cirugía se debe iniciar el reemplazo con levotiroxina y monitorear la concentración de TSH. Se puede utilizar calcio por vía oral y suplemento de calcitriol antes de la cirugía y de acuerdo con las concentraciones postoperatorias del calcio sérico.
► Efectos secundarios
Las complicaciones quirúrgicas son raras y ocurren en el 1-3% de los pacientes. La complicación más frecuente es la hipocalcemia debida al hipoparatiroidismo permanente, seguida por la lesión permanente del nervio laríngeo recurrente. El riesgo de estas complicaciones es menor cuando la tiroidectomía es realizada por un cirujano de tiroides experimentado.
Circunstancias especiales
► Tormenta tiroidea
La tormenta tiroidea es una enfermedad rara con una incidencia de 0,2/100.000 personas-año en Japón y se produce en el 1-5% de los pacientes hospitalizados por tirotoxicosis. Es una emergencia con una tasa de mortalidad elevada (8-25%).
La presentación no depende de las concentraciones séricas de hormonas tiroideas, que son similares a las de la tirotoxicosis compensada. Hasta en el 70% de los casos se puede identificar un disparador aparente: usualmente el uso poco fiable o la interrupción de un ATD, seguido por la infección. Otros factores de riesgo incluyen la enfermedad aguda, la cirugía tiroidea o no tiroidea (ahora menos común debido a una preparación preoperatoria adecuada), el trauma, el estrés y el embarazo.
La patogénesis de la tormenta tiroidea todavía es poco conocida. El diagnóstico es clínico y se basa en la presencia de hipertiroidismo en un paciente con manifestaciones graves y peligrosas para la vida. Para hacer el diagnóstico, Burch y Wartofsky propusieron un sistema de puntaje, modificado por Akamizu y col..
| Criterios diagnósticos para la tormenta tiroidea |
| Temperatura ºC | Puntos |
| 37,2-37,7 | 5 |
| 37,8-38,2 | 10 |
| 38,3-38,8 | 185 |
| 38,9-39,4 | 20 |
| 39,4-39,9 | 25 |
| >40 | 30 |
| Efectos en el sistema nervioso central |
| Ausente | 0 |
| Leve (agitación) | 10 |
| Moderado (delirio, psicosis, letargo extremo) | 20 |
| Grave (convulsiones, coma) | 30 |
| Disfunción hepática y gastrointestinal |
| Ausente | 0 |
| Moderada (diarrea, náusea/vómitos, dolor abdominal) | 10 |
| Grave (ictericia inexplicada) | 20 |
| Disfunción cardiovascular |
| 90-109 | 5 |
| 110-119 | 10 |
| 120-129 | 15 |
| 130-139 | 20 |
| ≥140 | 25 |
| Insuficiencia cardíaca congestiva |
| Ausente | 2 |
| Leve (edema podal) | 5 |
| Moderada (estertores bibasales) | 10 |
| Grave (edema pulmonar) | 15 |
| Fibrilación auricular |
| Ausente | 0 |
| Presente | 10 |
| Historia de precipitantes |
| Ausente | 0 |
| Presente | 10 |
| Un puntaje ≥45 es muy sugerente de tormenta tiroidea; un puntaje de 25-44 es sugerente de tormenta tiroidea inminente; un puntaje <25 es poco probable que represente una tormenta tiroidea. Datos son de Burch y Wartofsky. |
Se debe utilizar un enfoque terapéutico multidisciplinario. Los objetivos son reducir la síntesis y la secreción y circulación de las hormonas tiroideas, controlar los efectos periféricas de la hormona tiroidea, resolver la manifestación sistémica y el tratamiento de la precipitación de la enfermedad. Después de la mejoría de la función tiroidea, que generalmente se produce en 24 horas, el yodo puede ser discontinuado en forma gradual y los glucocorticoides disminuidos escalonadamente hasta suspenderlos. Los ATD y los bloqueantes ß deben titularse de acuerdo con la función de la tiroides. Después de que el paciente está eutiroideo se sugiere la tiroidectomía definitiva o la ablación con yodo radiactivo.
Hipertiroidismo en el embarazo y posparto
La causa más común de hipertiroidismo durante el embarazo es la enfermedad de Graves. La incidencia de hipertiroidismo en los EE.UU. es 5,9/1.000 embarazadas/año. Los resultados de un estudio de cohorte de base poblacional realizado en Dinamarca mostró una gran variación en el riesgo de hipertiroidismo durante el embarazo: elevado durante el primer trimestre y muy bajo en el tercero. El riesgo más elevado se observó 7-9 meses después del parto.
Las guías de ATA para el diagnóstico y manejo de la enfermedad tiroidea durante el embarazo y posparto recomienda medir las concentraciones séricas de T4 libre a todas las mujeres con concentraciones de TSH sérica <0,1 mUI/l. Esta recomendación está de acuerdo con la guía de la Endocrine Society, que sugiere medir las concentraciones totales de T3 y de los TRAb.
La evaluación de los TRAb es útil para detectar el riesgo de o hipertiroidismo fetal neonatal ya que los anticuerpos tiroideos cruzan la placenta; las concentraciones de TRAb deben ser evaluadas entre las semanas 20 y 24 de gestación. Las concentraciones séricas de la hormona tiroidea son importantes para distinguir el hipertiroidismo manifiesto del subclínico, porque el hipertiroidismo subclínico generalmente no necesita tratamiento durante el embarazo. Cuando se confirma el hipertiroidismo manifiesto, se debe excluir el síndrome de tirotoxicosis gestacional.
La tirotoxicosis es un trastorno benigno y transitorio que por lo general ocurre en el primer trimestre del embarazo, probablemente debido a las concentraciones elevadas de gonadotrofina coriónica humana o a una variante de la misma. Las características clínicas de la enfermedad de Graves y los TRAb están ausentes.
La tirotoxicosis gestacional solo necesita tratamiento sintomático. Por el contrario, el bocio nodular tóxico o la enfermedad de Graves se deben tratar con ATD. El propiltiouracilo se utiliza generalmente durante el primer trimestre del embarazo y luego se cambia por el tiamazol, en el segundo trimestre, debido al riesgo asociado de embriopatía del primer trimestre inducida por tiamazol.
Aunque algunos autores argumentan que esta asociación podría explicarse por el hipertiroidismo y no por la administración del ATD, los informes sobre las consecuencias del tiamidazol como los defectos de nacimiento, incluyendo la aplasia cutis, la atresia de las coanas, la atresia esofágica y el onfalocele, se han visto en los pacientes que recibieron tiamidazol y no en los hipertiroideos.
Aunque menos común, el propiltiouracilo también se ha demostrado que se asocia con los defectos neonatales en la cara y el cuello, y el sistema urinario. Después del primer trimestre, el ATD preferido es el tiamazol porque el propiltiouracilo tiene mayor riesgo de hepatotoxicidad. La dosis inicial es 5-15 mg/día para el tiamazol y 50-300 mg/día para el propiltiouracilo.
Cuando se cambia un ATD por otro, la dosis de propiltiouracilo equivalente al tiamazol sería 10-15:1. La función tiroidea debe ser evaluada a las 2 semanas de iniciado el ATD. Si las mujeres reciben ATD durante el embarazo, cada 2-6 semanas se deben medir las mediciones de TSH, T4 (normalmente 150% más elevada durante el embarazo) y T4 libre (o el índice de T4 libre). La T4 y la T4 libre (o el índice de T4 libre) deben estar en el límite superior o ligeramente por encima del rango de referencia normal, aunque algunos análisis de T4 libre no son fiables durante el embarazo debido a la presencia de concentraciones elevadas de la globulina de unión de T4.
Si los ATD están contraindicados o el hipertiroidismo no puede ser controlado adecuadamente mediante su administración, una alternativa es la tiroidectomía. La tiroidectomía se debe hacer durante el segundo trimestre del embarazo, para minimizar el efecto teratogénico potencial de los agentes anestésicos.
La terapia con yodo radiactivo está contraindicada en el embarazo, ya que atraviesa la placenta y puede causar hipotiroidismo grave en el feto. En el período posparto, el hipertiroidismo por enfermedad de Graves debe ser diferenciado de la tiroiditis linfocítica posparto. Si la enfermedad de Graves se diagnostica después del parto, las madres lactantes pueden tomar dosis moderadas de ATD en forma segura─es decir, hasta 20 mg/día de tiamazol o 300 mg/día de propiltiouracilo. Se recomienda que las madres lactantes tomen ATD inmediatamente después de la lactancia materna.
Tiroiditis subaguda dolorosa e indolora
Los pacientes con tiroiditis subaguda dolorosa o indolora (la mayoría de las que ocurren comúnmente durante el período postparto temprano) tiene un curso de tirotoxicosis autolimitado seguido de hipotiroidismo y por lo general con restauración de la función tiroidea. La tiroiditis indolora o tiroiditis linfocitaria posparto suele repetirse durante los embarazos posteriores y resultar en un hipotiroidismo permanente.
En la tiroiditis indolora o tiroiditis linfocítica posparto. casi siempre están presentes los anticuerpos antiperoxidasa tiroidea. Por lo tanto, estos pacientes necesitan el monitoreo periódico, durante toda su vida, para detectar el desarrollo de hipotiroidismo. Los ATD y la terapia con yodo radiactivo están contraindicados en ambos trastornos debido a que la síntesis de hormona tiroidea no se incrementa y la captación de yodo radiactivo de la tiroides es baja. En general, durante la fase tirotóxica se administran bloqueantes ß. Para aliviar el dolor de la glándula y los síntomas sistémicos en los pacientes con tiroiditis subaguda dolorosa pueden ser útiles los AINE o los salicilatos.
En los casos más grave se prefieren los glucocorticoides, como la prednisona en dosis de 15-40 mg/día, con una reducción lenta durante 4-6 semanas. Diferente de la conducta que se sigue con los pacientes con tiroiditis linfocítica subaguda indolora, los pacientes con tiroiditis subaguda dolorosa raramente desarrollan hipotiroidismo permanente.
Amiodarona y tirotoxicosis inducida por yodo
Cuando un paciente desarrolla tirotoxicosis inducida por amiodarona es extremadamente importante distinguir entre las dos formas de la tirotoxicosis inducida por amiodarona, porque el tratamiento es diferente. La tirotoxicosis inducida por amiodarona tipo I suele ocurrir cuando los pacientes con un bocio nodular eutiroideo o enfermedad de Graves latente están expuestos al elevado contenido de yodo de la amiodarona. Esta exposición conduce a un exceso de síntesis y liberación de hormonas tiroideas, como ocurre en el hipertiroidismo inducido por yodo en los pacientes que reciben un exceso de yodo de otro origen.
La tirotoxicosis inducida por
amiodarona tipo II es una tiroiditis destructiva causada por el efecto tóxico directo de la amiodarona en los tirocitos. Esta forma es generalmente autolimitada y, cuando es necesario, se puede continuar la administración de amiodarona. La
tirotoxicosis inducida por amiodarona tipo I se trata con ATD y, en algunos casos, mediante el agregado de perclorato de potasio, un inhibidor del sodio/cotransportador de yoduro, para inhibir la captación de yodo por la tiroides. En la tirotoxicosis inducida por amiodarona tipo II, se utilizan los glucocorticoides para tratar la inflamación e inhibir la conversión de T4 a T3 más activa en los tejidos periféricos, y por lo general se disminuyen en 6-8 semanas. En un paciente ocasional resistente a las otras formas de terapia, el último recurso podría ser la tiroidectomía.
Investigación futura
El tratamiento del hipertiroidismo no ha cambiado mucho en las últimas décadas. Las opciones varían entre un tratamiento a largo plazo, con el riesgo de recaída o, la ablación de la glándula con el consiguiente hipotiroidismo. Los ATD son una opción conservadora pero tienen una tasa de recaída del 50%. Sin embargo, la tiroidectomía y el tratamiento con yodo radiactivo son terapias definitivas, pero el hipotiroidismo resultante necesita el reemplazo hormonal tiroideo de por vida. Las investigaciones futuras deberían dedicarse a comprender mejor la patogénesis del hipertiroidismo de Graves para orientar el tratamiento a la causa subyacente del hipertiroidismo y obtener una cura segura, conservadora y definitiva.
Dado que las estrategias para evaluar y manejar el hipertiroidismo de Graves son diferentes en las regiones geográficas, serían útiles las guías de sociedades especializadas fuera de los EE. UU. ya que pueden representar mejor las diferentes características culturales y de población, y serían más aptas para la práctica de sus miembros.
Comentario y resumen objetivo: Dra. Marta Papponetti