Una mujer de 46 años fue vista en una clínica de ortopedia oncológica debido a dolor en cadera y pierna derechas. Varios meses antes, había presentado dolor en la parte media y alta del muslo derecho, que aumentó gradualmente en intensidad a pesar del tratamiento con ibuprofen, pantoprazol, y acetaminofen-codeína.
Cuatro semanas antes de esta evaluación, ella fue vista en otro hospital. En el examen, sus signos vitales estaban normales; su altura era de 156,2 cm, y su peso 44,5 kg. Había dolor en los músculos aductores medios, no había limitación en la movilidad activa ni pasiva de la cadera, y había dolor en la posición de pie. Dos semanas más tarde, una radiografía fue obtenida mostrando osteopenia difusa, una hiperclaridad mal definida en la región metadiafisaria de la tibia izquierda y elementos metálicos quirúrgicos en la cadera y cuello femoral derechos. Un centelleograma óseo mostró áreas de captación aumentada en hemipelvis derecha, en la región proximal de la tibia izquierda, y en el cráneo. Se derivó al servicio de ortopedia oncológica de este hospital.
A la edad de 25 años se hizo diagnóstico de enfermedad celíaca en base al examen de una biopsia de intestino delgado, al que la paciente había sido sometida, después de 3 meses de diarrea asociada a pérdida de 13,6 kg de peso en ese tiempo. En ese momento, su altura era de 162,6 cm y su peso de 41,7 kg, y se diagnosticó osteoporosis. Una fractura de muñeca derecha había ocurrido en la niñez, y a la edad de 12 años sufrió una epifisiolisis traumática de cadera derecha que había sido tratada con una reducción abierta y fijación interna.
Quince meses antes de la actual evaluación en este hospital, la paciente había tenido un accidente automovilístico; en ese momento se hicieron Rx de pelvis, cadera derecha, columna cervical, y tórax, las cuales revelaron profunda osteopenia y moderada cifosis pero no fracturas.
Los resultados de los tests de laboratorio realizados se muestran en la Tabla 1.
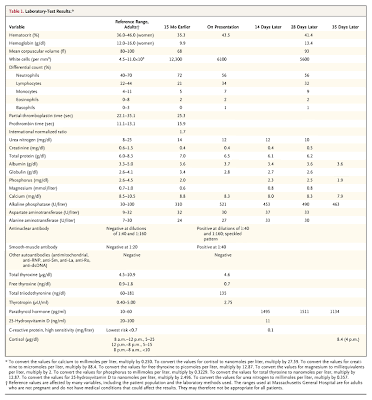 Tabla 1. Resultados de laboratorio.
Tabla 1. Resultados de laboratorio.
Clickear sobre la tabla para ampliarla
La paciente estaba casada, trabajaba en una oficina, y tenía dos hijos, ambos nacidos por cesárea. No refería alergias. Su medicación incluia clonacepan, oxicodona-acetaminofen, alendronato (intermitentemente por 1 año) y suplementos de hierro. Tomaba vitamina D y suplementos de calcio intermitentemente y seguía una dieta libre de gluten en forma intermitente. No tomaba diuréticos ni tenía historia de exposición a radiaciones. Su padre tenía epilepsia postraumática y cáncer de colon, su madre tenía enfermedad de Parkinson y osteoporosis, y su abuela, cáncer de pulmón.
En el examen, la paciente impresionaba en buen estado general. Su marcha era antálgica, y había dolor en la rotación externa e interna de la cadera derecha. No había dolor a la movilización activa ni pasiva de otras articulaciones, ni dolía la compresión de la pelvis. El resto del examen era normal. Los niveles de electrolitos, glucosa, y bilirrubina fue normal. Los resultados de otros tests de laboratorio son mostrados en la Tabla 1.
Estudios de imágenes fueron llevados a cabo durante el mes siguiente. La RMN de las piernas y de la pelvis, llevada a cabo después de la administración de gadolinio, reveló múltiples masas intraóseas, incluyendo una gran masa (8 cm por 7 cm por 3,5 cm) en la región posterior de la hemipelvis derecha, y una lesión menor (3,3 cm por 1,5 cm por 1,8 cm)en la región anterosuperior de la tibia izquierda. Otras pequeñas anormalidades fueron también vistas. Había realce homogéneo de las lesiones. Esos hallazgos estaban sobreimpuestos sobre una alteración generalizada de la señal de la médula ósea, caracterizada por baja intensidad de señal en T1 y alta intensidad de señal en T2 (hallazgos sugestivos de un proceso infiltrativo reemplazando la médula ósea).
Las Rx de cráneo mostraron profunda osteopenia con distribución en parches. Las Rx de caderas y pelvis, mostraron la presencia de objetos ortopédicos metálicos en cuello femoral derecho y una pequeña hipodensidad a lo largo de la rama isquiopubiana derecha.
La TAC de tórax, abdomen y pelvis sugirió la posibilidad de lesiones líticas en ambas cabezas humerales. También mostraron resorción de la unión esterno-manubrial; un nódulo de 2 mm de diámetro, en cada lóbulo pulmonar superior; una lesión de aspecto de partes blandas de alta densidad hacía procidencia en el esófago cervical hacia a derecha; una lesión destructiva del hueso ilíaco derecho por una masa de partes blandas; una lesión lítica mas chica en isquion; y cambios difusos en el resto de los huesos ilíacos y sacro bilateralmente. Una RMN de cerebro fue normal.
Cuatro semanas después de la evaluación inicial, la paciente fue derivada a un cirujano oncólogico con orientación endocrinológica. Además del dolor óseo, la paciente tenía fatiga, pero no tenía constipación, dolor abdominal, pérdida de peso, debilidad muscular, pérdida de memoria, úlcera péptica, o pancreatitis. Su altura era de 154,9 cm, y el peso era de 48,4 kg. Su presión sanguínea era de 92/56 mmHg, y su pulso de 68 por minuto; la frecuencia respiratoria de 16 por minuto. La temperatura era normal. El examen de la glándula tiroides mostró que esta era normal; no había ganglios linfáticos agrandados palpables. El resto del examen físico no había variado de los hallazgos de 4 semanas antes. Un examen ultrasónico del cuello llevado a cabo en consultorio reveló una tiroides normal, y una estructura hipoecoica oval de 1,2 cm de diámetro, cerca del polo inferior derecho que era sugestivo de glándula paratiroides agrandada.
Se comenzó tratamiento con vitamina D (50.000 UI por semana), y se le aconsejo a la paciente que recomenzara una dieta libre de gluten. Se derivó a un endocrinólogo; en la primera visita, 1 semana más tarde, el examen físico mostró inflamación, pero sin dolor sobre la tibia izquierda en su región anterior; el resto del examen no mostró cambios; los resultados de otros tests de laboratorio se muestran en la Tabla 1.
Diez días más tarde, se llevó a cabo un procedimiento diagnóstico.
Diagnóstico diferencial:
Dr. Marie B. Demay: Esta mujer de 46 años, con antecedentes de enfermedad celíaca de larga data, y mala adherencia al tratamiento dietético, desarrolló dolor óseo, y en las radografías mostró lesiones óseas, que no estaban presentes 15 meses antes de la presentación. Son las lesiones esqueléticas consecuencia de enfermedad ósea metabólica o de un tumor maligno?
La osteoporosis no causa lesiones osteolíticas, pero otras enfermedades óseas metabólicas, como la enfermedad de Paget, la osteomalacia, y la osteítis fibrosa quística deben ser consideradas en el diagnóstico diferencial. Las imágenes serán de utilidad en el diagnóstico diferencial de estas entidades.
Dr. Daniel I. Rosenthal: Las radiografías de la columna y pelvis, obtenidas 1 año antes de la actual admisión debido a un accidente automovilístico, mostró severa osteopenia sin evidencia de fracturas (Figura 1 A).
Figura 1. Radiografías de pelvis y cráneo
Una radiografía de pelvis obtenidad debido a un accidente automovilístico 15 meses antes de la actual evaluación (Panel A) muestra profunda pérdida de hueso. Tornillos están presentes en cabeza y cuello femoral derecho. Una radiografía de pelvis de la actual evaluación (Panel B) muestra una lesión lítica de la rama isquiopubiana con fractura patológica (flecha). Una radiografía lateral de cráneo (Panel C) es difusamente anormal. El cráneo tiene un aspecto moteado, con áreas de densidad normal alternando con áreas de diminutas hipodensidades. Una vista amplificada del cráneo (Panel D) muestra la anormalidad ósea.
Se observan elementos metálicos en la región proximal del fémur de una fijación previa. En la región posterior del ilion, una débilmente visible línea esclerótica parece demarcar los bordes. Una radiografía de pelvis obtenida para la actual evaluación muestra una lesión lítica en el ilion derecho, delimitado por una débil línea esclerótica; la lesión es similar a la observada en una radiografía de pelvis previa (Figura 1 B). Además, hay una hipodensidad en el pubis inferior, que probablemente representa una fractura no desplazada. Una Rx de cráneo (Figuras 1 C y 1 D) muestran un patrón generalizado de densidad moteada, entremezclada con zonas óseas de desnsidad preservada.
La RMN de la pierna, llevada a cabo en la actual evaluación (Figura 2 Ay 2 B) muestra un área de anormalidad focal en la médula ósea de la tibia, sobreimpuesta en una médula ósea anormal dentro de la tibia. Un realce marcado de contraste es observado en el área anormal. La RMN de pelvis (Figura 2 C y 2 D) muestra reemplazo focal de la médula en la región posterior del ilion. Hay áreas centrales punteadas de baja intensidad de señal, que sugieren calcificación, o fragmentos óseos trabeculares retenidos. Un patrón de anormalidad difusa similar a la observada en la tibia, es también evidente.
Figura 2. RMN de pierna derecha y pelvis. 
Una RMN de pierna (Panel A) muestra una lesión ósea focal de la médula (flecha), con marcado realce de contraste indicando flujo sanguíneo aumentado. En un corte sagital de RMN en T2 de la pierna (Panel B), la médula ósea tiene una apariencia parcheada difusa. Hay reemplazo focal de la médula del ileon posterior derecho (Panel C, flechas). Las cortezas anterior y posterior parecen ausentes (Panel DLa TAC de las dos lesiones pélvicas (Figura 3 A, y 3B) muestra una masa de partes blandas en la médula ósea del ileon posterior derecho, extendiéndose anteriormente en los tejidos blandos debajo del músculo psoas.
 Figura 3. TAC de pelvis.
Figura 3. TAC de pelvis.
Los estudios con TAC confirman la presencia de lesiones destructivas del ileon posterior (Panel A, flecha) Una imagen más caudal muestra lesiones líticas y un fractura patológica del pubis. (Panel B, flecha).
Dr. Demay: La enfermedad celíaca, que afecta aproximadamente 1% de la población de los EE UU, es consecuencia de sensibilidad al gluten del trigo ingerido y a proteínas relacionadas en la cebada y centeno. Esto lleva a la injuria mucosa del intestino delgado, pérdida de la estructura vellosa intestinal, y malabsorción.
Tumores malignos en la enfermedad celíaca.
Las lesiones esqueléticas de esta paciente despiertan preocupación acerca de cáncer. Los pacientes con enfermedad celíaca no tratada o tratada sin respuesta tienen una incidencia aumentada de linfomas intestinales de células T y adenocarcinomas. (1,2) El diagnóstico temprano y el tratamiento de la enfermedad celíaca pueden reducir el riesgo de neoplasia. (2) El diagnóstico en este caso fue hecho cuando la paciente tenía 21 años, pero su adherencia al tratamiento dietético fue pobre. Así, tanto un linfoma, como un carcinoma metastásico son causas potenciales de lesiones esqueléticas en este caso. Sin embargo, las metástasis esqueléticas de origen en el tubo digestivo serían muy inusuales, en ausencia de metástasis hepáticas, y la ausencia de dolor abdominal, síntomas generales, y citopenias en sangre periférica, hacen improbable también el compromiso de la médula ósea por un linfoma intestinal.
Hiperparatiroidismo en la enfermedad celíaca.
Los tests de laboratorio llevados a cabo 15 meses antes de la presentación reveláron una anemia microcítica, hallazgo consistente con deficiencia de hierro debido a malabsorción.
El calcio sérico del paciente estaba en el rango normal a bajo; sin embargo, ella tuvo hipofosfatemia, y un nivel de fosfatasa alcalina que era más de 3 veces el límite superior normal. En ausencia de enfermedad hepática, o niveles de calcio y fósforo anormales, un aumento aislado de la fosfatasa alcalina en una persona sana, sugiere el diagnóstico de enfermedad de Paget. Sin embargo, el bajo nivel de fósforo, sugiere otra causa de aumento de la fosfatasa alcalina. Aunque la hormona paratiroidea y los niveles de 25-hidroxivitamina D no fueron chequeados en ese momento, la presencia de hipofosfatemia en el contexto de nivel de calcio sérico normal a bajo, sugiere hiperparatiroidismo secundario, debido a malabsorción de calcio, y deficiencia de vitamina D. En el momento de la consulta, la paciente tenía hipocalcemia, hipofosfatemia, y un impresionante aumento de la hormona paratiroidea, acompañado de una deficiencia de vitamina D.
La presencia de hiperparatiroidismo es una respuesta homeostática a la hipocalcemia. La hormona paratiroidea aumenta la resorción ósea, a través de una actividad osteoclástica aumentada, (3) disminuye el clearence renal de calcio, aumenta el clearence renal de fósforo, y aumenta el nivel sérico de 1,25-dihidroxivitamina D, estimulando la absorción intestinal de calcio.
Sin embargo, en esta paciente, la injuria a la mucosa intestinal, puede haber evitado un aumento en la absorción intestinal de calcio. Más aún, la hipofosfatemia y la hipocalcemia crónica, llevan a un fracaso en la mineralización de la matriz ósea, condición conocida como osteomalacia.
Con la osteomalacia, hay un marcado trastorno en la resorción de hueso debido a que la mayor parte del hueso mineralizado está cubierto por una matriz osteoide no mineralizada, que no puede entonces ser reabsorbida por los osteoclastos. Así, la hipocalcemia, puede ocurrir a pesar de la presencia de hiperparatiroidismo secundario, estimulando más aún las glándulas paratiroideas, y conduciendo a su agrandamiento.
En este caso, la presencia de un nivel de paratormona alta, en el contexto de un bajo nivel de vitamina D, bajo nivel de calcio y fósforo, y niveles normales de creatinina, son indicativos de hiperparatiroidismo secundario de larga data, asociado a deficiencia de vitamina D y malabsorción de calcio.
Sin embargo, las lesiones óseas, no son típicas de este trastorno. Los clásicos hallazgos observados en la osteomalacia son las seudofracturas, que corresponden a regiones de hueso no mineralizado que impresiona radiograficamente como una fractura. Esta paciente tiene lesiones líticas, que son más consistentes con osteítis fibrosa quística.
Osteítis Fibrosa Quística.
La Osteítis Fibrosa Quística (también conocida como enfermedad de Von Recklinghausen), es clásicamente vista en pacientes con hiperparatiroidismo primario. (4) Aunque era una condición común en el siglo pasado, es raramente vista hoy en día, probablemente debido a que los tests bioquímicos de rutina identifican antes a los pacientes con hiperparatiroidismo primario, sin darle al proceso el tiempo necesario para que desarrollen las complicaciones esqueléticas. (5) La osteítis fibrosa quística se caracteriza por desmineralización esquelética generalizada, resorción ósea subperióstica que conduce al afinamiento cortical, la presencia de tumores pardos (osteoclastomas) que son manifestados como lesiones líticas, y quistes óseos que pueden disrumpir la corteza que los recubre. Las Rx de cráneo revela una apariencia en “sal y pimienta”, con pérdida de la definición de la corteza, como se vió en esta paciente, y reemplazo fibrovascular de la médula ósea, que puede dar cuenta de los cambios de la médula ósea observados en la RMN.
La osteítis fibrosa quística es extremadamente rara en el hiperparatiroidismo secundario asociado a malabsorción de calcio debido a que los osteoclastos no pueden reabsorber el hueso no mineralizado.
Sin embargo, la adherencia intermitente al régimen dietético de esta paciente puede haber llevado a normalización de sus niveles de calcio y fósforo, y a mineralización de las lesiones osteomalácicas. En casos de hiperparatiroidismo de larga data, puede llevar varios meses la normalización de los niveles de hormona paratiroidea; consecuentemente, elevaciones persistentes de esos niveles, cuando las lesiones osteomalácicas han sido mineralizadas, conduciría al desarrolllo de tumores pardos y de quistes óseos. Un nivel de parathormona crónicamente elevada podría esperarse que lleve a cambios fibrovasculares en la médula ósea. Un reciente reporte notó la presencia de lesiones líticas en un paciente con hiperparatiroidismo secundario (6) que se resolvió con terapia con vitamina D.
Adenoma o carcinoma paratiroideo
Los marcadamente elevados niveles de hormona paratiroidea son compatibles con el diagnóstico de hiperparatiroidismo secundario debido a deficiencia de calcio y vitamina D, pero ellos pueden estar asociados con adenoma o carcinoma paratiroideo. En pacientes con insuficiencia renal crónica, la autonomía paratiroidea puede desarrollar debido a cambios genéticos que resultan en expansión clonal de células, que lleva a función autónoma de una o más glándulas. En este caso, la presencia en el examen ultrasónico de lo que parece ser una glándula paratiroidea agrandada puede reflejar hiperplasia asimétrica, o la presencia de adenoma. Sin embargo, no hay evidencia que este paciente tuviera autonomía paratiroidea.
Tampoco se puede descartar la remota posibilidad que esta paciente tenga carcinoma paratiroideo con metástasis óseas. Los cánceres paratiroideos han sido reportados en pacientes con enfermedad celíaca (7,8) así como en aquellos con hiperplasia paratiroidea por insuficiencia renal crónica. En tales pacientes, se ha propuesto que la estimulación crónica de las glándulas paratiroides conduce no solo a la autonomía, sino también a la transformación maligna; sin embargo, los carcinomas paratiroideos son extremadamente raros, y ese diagnóstico es improbable.
Resumen:
Yo creo que este paciente tiene osteítis fibrosa quística debido a hiperparatiroidismo secundario, a consecuencia de enfermedad celíaca, con malabsorción de vitamina D y calcio. Aunque la apariencia del cráneo en “sal y pimienta” es un hallazgo clásico en el hiperparatiroidismo, y las lesiones tibiales tienen características de tumor pardo, la naturaleza destructiva de las lesiones de la cresta ilíaca son de alguna preocupación. Para establecer el diagnóstico y descartar tumor maligno, una biopsia de cresta ilíaca debe ser llevada a cabo.
Dr. Nancy Lee Harris (Patología): Podemos saber cuál es el diagnóstico de los estudiantes?
Diagnóstico de estudiantes de la Harvard Medical School : Esta paciente tenía una enfermedad celíaca, osteopenia, y dolor óseo, con bajos niveles séricos de calcio, fósforo y vitamina D, y un alto nivel de hormona paratiroidea. Las imágenes radiográficas mostraron lesiones líticas pero con realce, una apariencia craneal en “sal y pimienta” y había un nódulo en el cuello sugestivo de agrandamiento de la glándula paratiroidea. Juntos, esos hallazgos sugieren el diagnóstico de deficiencia de vitamina D debido a malabsorción, que condujo a severa hipocalcemia de larga data, hiperparatiroidismo secundario y tumores pardos de hueso.
Dr. Harris: Drs. Stephen and Barbesino, podrían decirnos qué pensaron cuando vieron por primera vez a esta paciente?
Dr. Antonia Stephen (Cirugía endocrinológica): Esta paciente me fue derivada por un cirujano ortopédico en el momento de la presentación inicial, antes de la consulta al servicio de Clínica Médica. Yo creí que los resultados de los tests de laboratorio eran consistentes con hiperparatiroidismo secundario. Llevé a cabo un examen con ultrasonido en mi consultorio y noté una lesión oval, hipoecoica, de 1,2 cm de diámetro lindante con el polo inferior derecho de la tiroides, que sugirió adenoma paratiroideo inferior derecho; no fueron vistas otras zonas de agrandamiento paratiroideo. Esto no es típico de hiperparatiroidismo secundario, en el que se hubiera esperado agrandamiento de las cuatro glándulas. Sin embargo, yo sospeché que la paciente tenía agrandamiento de las cuatro glándulas, con una glándula dominante vista en la ultrasonografía.
Dr. Giuseppe Barbesino (Endocrinología): Cuando ví por primera vez a esta paciente, pensé que tenía un severo hiperparatiroidismo secundario con osteítis fibrosa quística por malabsorción de calcio y vitamina D de larga data. Yo solicité una biopsia guiada por TAC de las cresta ilíaca.
Discusión patológica
Dr. Vikram Deshpande: El diagnóstico de la muestra de biopsia no contenía hueso cortical, y consistía en células gigantes multinucleadas, consistentes con osteoclastos, y células del estroma, que iban desde ovales hasta algunas con forma de huso. (Figura 4) Abundante pigmento de hemosiderina estaba presente. En el examen macroscópico, la hemosiderina le daba a la muestra una apariencia marrón o “parda”. La apariencia histológica era característica de un tumor pardo. Una muestra de biopsia intestinal llevada acabo 25 años antes no estaba disponible para revisión, aunque fue informada como atrofia vellositaria consistente con enfermedad celíaca.
 Figura 4: Biopsia del hueso ilíaco (Hematoxilina y eosina)
Figura 4: Biopsia del hueso ilíaco (Hematoxilina y eosina)
A baja magnificación (Panel A), el hueso es visto siendo reemplazado por un infiltrado de células gigantes en aguja. A mayor aumento (Panel B), las células gigantes osteoclásticas, y las células mononucleares del estroma son vistas, hallazgos consistentes con tumor pardo de hiperparatiroidismo.
El marcador histológico de la osteítis fibrosa quística es la osteítis disecante y la proliferación paratrabecular de células en huso que muestran diferenciación con la línea osteoblástica. (9) La muestra de biopsia de esta paciente no tenía hueso lamelar, por lo tanto no se pudo evaluar para esos cambios histológicos. Los llamados tumores pardos se forman cuando hay una extensa destrucción ósea, con hemorragias y acumulación de gran número de células gigantes osteoclásticas.
Discusión de manejo.
Dr. Demay: La osteítis fibrosa quística debe responder a la terapia médica, incluyendo adherencia a la dieta libre de gluten, suplementación de calcio, y reposición de vitamina D (6); al normalizar los niveles séricos de calcio, cabría esperar un descenso de los niveles de parathormona. Sin embargo, debido a la cronicidad del hiperparatiroidismo secundario, esta paciente tiene agrandamiento de sus glándulas paratiroideas, lo que significa que los niveles de parathormona pueden no normalizarse hasta que las glándulas involucionen en tamaño, lo que podría tomar varios meses de normocalcemia. La adecuación de los niveles de vitamina D y calcio a través de la suplementación, debe ser monitoreada midiendo niveles séricos de calcio y 25-hidroxivitamina D, así como evaluar la orina de 24 hs para evaluar niveles de calcio. Aunque los hallazgos del ultrasonido en este caso no son consistentes con el diagnóstico de hiperparatiroidismo primario; así , la paratiroidectomía no está indicada a menos que el tratamiento desenmascare autonomía paratiroidea.
Dr. Harris: Dr. Barbesino, como manejó a la paciente?
Dr. Barbesino: Yo recomendé a la paciente que reasumiera la dieta libre de gluten, y que tome vitamina D y altas dosis de calcio. Le recomendé visitas frecuentes para tests en sangre.
Mi preocupación era que como tenía una sola glándula agrandada, con niveles de parathormona marcadamente elevados, podría tener un hiperparatiroidismo terciario (autónomo) enmascarado por la hipocalcemia o normocalcemia por la malabsorción, y que cuando comenzara a cumplir correctamente con la dieta pudiese manifestarse la hipercalcemia, potenciada por las altas dosis de calcio y vitamina D en la dieta.
Desafortunadamente la paciente no regresó a visitas de seguimiento a pesar de numerosos llamados telefónicos y cartas enviadas
Dr. Harris: Usted cree que la corta estatura de la paciente y las fracturas que ella tuvo antes del diagnóstico de enfermedad celíaca fueron consecuencia de enfermedad celíaca no diagnosticada hasta ese momento?
Dr. Demay: A los 21 años, cuando la enfermedad celíaca fue diagnosticada, ella tenía marcada osteopenia, sugiriendo que ella había tenido enfermedad celíaca de mucho tiempo de evolución, que pudo haber afectado tanto su crecimiento potencial como el desarrollo del pico de masa ósea.
Dr. Rosenthal: Con la osteomalacia o con el raquitismo en los niños, el cartílago de crecimiento está agrandado debido a mineralización retardada, que puede predisponer a los niños a la epifisiolisis; quizás fue ese el caso de esta paciente.
Diagnóstico anatómico:
Tumor pardo asociado a osteítis fibrosa quística en una paciente con enfermedad celíaca, malabsorción, deficiencia de vitamina D, hipocalcemia, e hiperparatiroidismo secundario.
Fuente
From the Endocrine Unit (M.B.D.) and the Departments of Radiology (D.I.R.) and Pathology (V.D.), Massachusetts General Hospital; and the Departments of Medicine (M.B.D.), Radiology (D.I.R.), and Pathology (V.D.), Harvard Medical School.
Traducción de:
Case 16-2008 — A 46-Year-Old Woman with Bone Pain
Marie B. Demay, M.D., Daniel I. Rosenthal, M.D., and Vikram Deshpande, M.D.
The New England of MedicineVolume 358:2266-2274
May 22, 2008 Number 21
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL

















