Revista Médica Clínica Las CondesVol. 21. Núm. 6.
La Enfermedad de Graves corresponde a un síndrome que comprende: bocio hipertiroídeo habitualmente, oftalmopatía asociada a la tiroides y dermatopatía. No se cuenta con estadísticas nacionales, sin embargo la mayoría de los estudios internacionales muestran una frecuencia mayor en la mujer. Desde el punto de vista del manejo quirúrgico de esta enfermedad, éste se basa en tres etapas fundamentales: descompresión orbitaria, cirugía de los músculos extraoculares y finalmente la cirugía de reposicionamiento palpebral, no todos los pacientes requieren estos tres tipos de tratamiento, pero en caso de necesitarlos esta debe ser la secuencia. La indicación quirúrgica dependerá de la fase en que se encuentre el paciente, idealmente deberá realizarse en la fase de inactividad de la enfermedad
caracterizada por la ausencia de signología inflamatoria periocular.
Este artículo está destinado a mostrar las alternativas quirúrgicas en el tratamiento de las complicaciones oculares de la Orbitopatía de Graves orientado principalmente hacia el exoftálmo y la patología palpebral.
Introducción
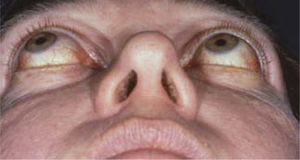
La Enfermedad de Graves (EG) es un síndrome que comprende: bocio hipertiroídeo habitualmente, oftalmopatía asociada a la tiroides y dermatopatía (1, 2). En Estados Unidos la prevalencia de la EG es de aproximadamente 0,4% (3), lamentablemente no contamos con cifras nacionales. La mayoría de los estudios muestran una mayor frecuencia en la mujer con cifras que van desde 2,5:1 hasta 7:1, sin embargo en la mayoría de los trabajos esta relación es de 4:1(4, 5, 6).La EG es la forma más común de hipertiroidismo en pacientes entre la 3 a 5 décadas, pero puede presentarse con muchísimo menor frecuencia con hipotiroidismo e incluso eutiroideos. Los pacientes con EG tiene un riesgo mayor de presentar otras enfermedades autoinmunes como: Diabetes Mellitus insulinodependiente, Artritis Reumatoidea, Anemia Perniciosa y Vitíligo (7, 8, 9, 10). Rara vez la EG puede presentares en la niñez o en adultos jóvenes (11) (Figura 1).
Figura 1.Foto de paciente adolescente con exoftálmo y retracción palpebral.
El curso clínico desde el punto de vista glandular de la EG es usualmente predecible en contraste con la oftalmopatía que tiende a ser muy impredecible y difícil de tratar. La oftalmopatía está presente entre el 10 al 45% de los pacientes con EG con manifestaciones clínicas que pueden ir desde una irritación ocular leve hasta proptosis severa, estrabismo y neuropatía óptica compresiva (1, 2). La relación entre la disfunción glandular y la oftalmopatía persiste siendo poco clara. El aumento de volumen de los músculos extraoculares y del tejido conectivo/graso resulta de un aumento de la adipogénesis, la acumulación de glicosaminoglicanos no sulfatados y hialuronatos (12). La infiltración orbitaria de células inmunocompetentes como los Linfocitos T y mastocitos que producen mediadores como las citoquinas, pueden culminar en un proceso de remodelación tisular provocando fibrosis en los músculos extraoculares cuyo resultado es la alteración de la motilidad y por ende estrabismo (13), sin embargo la causa que provoca la infiltración orbitaria y tiroídea por estas células es aún desconocida. Para lograr un
Para lograr un manejo adecuado en esta patología es fundamental una estrecha colaboración entre el endocrinólogo y el oftalmólogo.
En este artículo nos abocaremos al manejo quirúrgico de las complicaciones oftalmológicas de la EG que se basa en tres etapas terapéuticas que no necesariamente requieren todos los pacientes, sin embargo de presentarse el tratamiento debe cumplir esta secuencia:
- 1.
-Descompresión orbitaria.
- 2.
-Cirugía de músculos extraoculares.
- 3.
-Cirugía de reposicionamiento de los párpados.
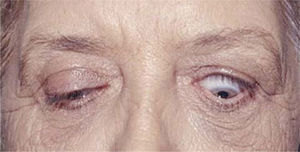
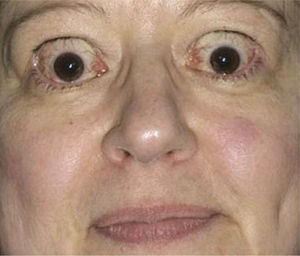
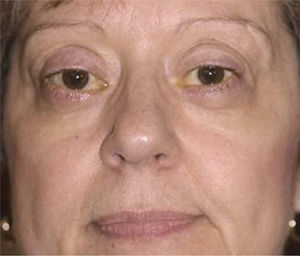
Para realizar la reparación de las complicaciones de la Oftalmopatía de Graves la enfermedad idealmente debe estar en una fase de estabilización caracterizada por la ausencia de signos inflamatorios perioculares pudiendo persistir la proptosis, estrabismo y la retracción palpebral (Figura 2).
- 3.
Foto de paciente con signos de actividad de la enfermedad: estrabismo, exoftálmo retracción y edema palpebral superior.
Descompresión orbitaria
El concepto de la descompresión orbitaria está basado en aumentar el volumen orbitario. Para ello se remueve quirúrgicamente o se esculpe una de las cuatro paredes de la órbita creando un mayor espacio con lo que disminuye la presión retrobulbar y la proptosis.
La indicación de la descompresión orbitaria dependerá de la fase en que se encuentre el paciente, estos en fase aguda requieren una cirugía urgente cuando presentan ulceración corneal por exoftalmo severo, subluxación ocular o neuropatía óptica compresiva, condición que a mi juicio es la más frecuente, esta indicación puede ser la primera línea de tratamiento o en casos de falla a la terapia con Glucocorticoides. Con mayor frecuencia la cirugía se realiza en forma electiva para tratar el exoftalmo deformante y el dolor orbitario persistente.
Múltiples abordajes se han usado que dependen principalmente de cada cirujano, mi elección personal es la descompresión orbitaria balanceada que es capaz de aliviar la presión sobre el nervio óptico y disminuir la proptosis. El volumen orbitario se expande realizando:
- a.
-Orbitotomía transcaruncular para efectuar una etmoidectomía.
- b.
-Orbitotomía lateral con fractura de pared.
- c.
-Fresando la zona más posterior de la pared desgastando el ala mayor del esfenoides.
Esta técnica quirúrgica puede asociarse a la extirpación de otra pared orbitaria, el piso logrando un mayor volumen y por ende una disminución de la proptosis. (Figuras 3A y 3B).
- c.
- Figura 3A.
Foto de preoperatoria de paciente con exoftáo severo.
Figura 3B.Foto postoperatoria de descompresión orbitaria de 3 paredes.
Técnica quirúrgica de la descompresión orbitaria balanceada
Se realiza bajo anestesia general, adicionalmente su infiltra la pared lateral y medial con una solución anestésica con la que disminuimos los requerimientos de agentes anestésicos generales y ayuda con el control del dolor postoperatorio.
Se efectúa una cantotomía y cantolisis superior e inferior del canto lateral, se escinde el músculo orbicular y se expone el periostio de la pared lateral de la órbita, usando un bisturí # 15 o la aguja de Colorado se realiza la apertura del periostio el que luego se diseca para exponer la pared ósea ampliamente, a esta se le realiza una osteotomía sobre la sutura frontomalar y otra en el malar sobre el arco zigomático, luego se fractura la pared entre las dos incisiones óseas luxándola hacia temporal. Para mantener la pared en esta nueva posición se coloca 1 tornillo en cada osteotomía de manera que no pueda volver a su posición anatómica, posteriormente se fresa el ala mayor del esfenoides entre la fisura orbitaria superior e inferior usando un motor de alta velocidad. Se controla la hemostasia usando cauterio y cera de hueso. Una vez logrado el aumento de volumen óseo se abre la periorbita permitiendo que el contenido orbitario ocupe este nuevo espacio. A continuación se realiza la orbitotomía medial transcaruncular para ello se infiltra la carúncula con la solución anestésica y se efectúa una incisión entre la carúncula y el pliegue semilunar, luego se amplia la incisión y se diseca en forma roma hasta alcanzar la pared medial, se abre la periórbita y se expone la lámina papirácea de etmoides, se diseca la periórbita y se identifican las arterias etmoidales anterior y posterior las que se encuentran el la sutura frontoetmoidal, esta sutura es el límite superior de nuestra futura osteotomía. Las arterias etmoidales se electrocoagulan con cauterio bipolar y se realiza la fractura y resección de la lámina papirácea y las celdillas etmoidales del lado comprometido. Se debe resecar la mucosa que está presente en las celdillas para prevenir hemorragias posteriores. Es fundamental al realizar la descompresión hasta resecar todas las celdillas especialmente las más posteriores al igual de la porción más posterior de la lámina papirácea para lograr una descompresión adecuada del apex orbitario y con ello aliviar la presión sobre el nervio óptico. Finalmente se abre la periórbita logrando que la grasa orbitaria y especialmente el recto medio ocupen la zona de la etmoidectomía.
Una vez revisada la hemostasia se realiza el cierre de las incisiones las que desde el punto de vista estético son casi imperceptibles, ya que en el caso de la incisión transcaruncular esta se realiza en la conjuntiva sin dejar cicatriz y por otra parte la incisión del canto lateral tiene entre 5 a 10mm. y se efectúa en una zona de pliegue natural por lo que estéticamente es muy adecuada.
Si el paciente presenta un exoftalmo muy severo y se requiere un mayor volumen orbitario descompresión balanceada se puede asociar una descompresión de piso de órbita la que puede hacerse en conjunto o postergarse para un segundo tiempo.
La técnica quirúrgica consiste en realizar una incisión transconjuntival (cara posterior del párpado) para no dejar cicatriz visible, se realiza una disección en plano preseptal (cara posterior del músculo orbicular) hasta el reborde orbitario, se escinde el periostio y se diseca exponiendo todo el piso de la órbita, luego de fractura el piso y se reseca casi completamente, especial atención debe tenerse en no dañar el nervio infraorbitario, la mayoría de los pacientes presenta hipoestesia de su territorio en el postoperatorio, esta se recupera en un plazo variable que habitualmente es de 6 a 8 semanas. Una vez resecado el piso se abre nuevamente la periórbita permitiendo que el contenido orbitario ocupe parcialmente el seno maxilar con lo que se alcanza un mayor volumen orbitario.
En cuanto a las complicaciones postoperatorias la hemorragia orbitaria es la más grave y potencialmente puede llegar a provocar pérdida de agudeza visual e incluso ceguera por ello la recomendación es realizar cada ojo por separado. Para evitar esta complicación es necesario ser extremadamente cuidadoso con la hemostasia intraoperatoria, especialmente en prevenir hemorragias provenientes de vasos de mayor flujo como las arteria etmoidales e infraorbitaria. A pesar de que el contenido orbitario toma contacto con las cavidades paranasales es muy poco frecuente la presencia de infecciones. La complicación más frecuente es la aparición de diplopia postoperatoria que en el caso de la descompresión balanceada puede ser de aproximadamente 10% (14) y aumentar hasta el 30% si se agrega la descompresión del piso.
La descompresión grasa ha sido propuesta como técnica aislada o en combinación con descompresión ósea. La grasa intraconal que es la que se ubica en el espacio retrocular, dentro del cono muscular compuesto por los músculos rectos, debe ser removida en forma cuidadosa para no dañar estructuras vasculares ni nerviosas que podrían ocasiones complicaciones severas de la motilidad ocular y la visión. La mayor indicación para remover grasa es la del paciente que tiene una gran cantidad de tejido graso que provoca estiramiento del nervio óptico, pero con músculos delgados, condición que clínicamente es muy poco frecuente. Personalmente considero que la descompresión ósea como la técnica de elección y la resección conservadora de grasa como un técnica complementaria (15) (Figuras 4A, 4B, 5A y 5B).
- Figura 4A.
Foto de TAC preoperatorio que muestra gran aumento de volumen de músculos extraoculares, especialmente el recto inferior.
Figura 4B.
Foto postoperatoria donde se muestra la descompresión de pared medial y piso de órbita derecho.

La miopatía restrictiva puede resolverse espontáneamente en un período de 1 a 2 años, si no ocurre el estrabismo puede corregirse quirúrgicamente después de 6 meses de estabilidad, esto significa que no exista variación en el ángulo de desviación de los ojos antes de realizar la cirugía (16). Se espera lograr una pequeña subcorrección del estrabismo para prevenir una sobrecorrección tardía. El uso de toxina botulínica también se ha demostrado de utilidad en ciertos casos y la técnica consiste en inyectar una pequeña cantidad de toxina en el vientre muscular del músculo que presenta restricción.
En cuanto al estrabismo ocasionado por la descompresión orbitaria este sigue el mismo criterio de estabilización.
Cirugía de reposicionamiento palpebralLa cirugía palpebral es la última etapa, ya que grandes modificaciones de la posición de los músculos verticales en la cirugía del estrabismo pueden aumentar la retracción palpebral debido a la conexión anatómica de los complejos retractores de los párpado con los músculos verticales (recto superior e inferior). La cirugía está destinada a corregir la retracción palpebral para disminuir la exposición corneal y/o lograr la rehabilitación estética del paciente.
La técnica a emplear para lograr un resultado adecuado dependerá del grado de severidad de la condición del paciente.
Retracción palpebral superiorEn casos de retracción mínima 1 a 1,5mm. La resección del Músculo de Müller puede ser suficiente, se realiza por vía conjuntival evertiendo el párpado, se escinde la conjuntiva sobre el borde superior del tarso y se diseca el músculo de Müller (que tiene inervación simpática y es el responsable de 1 a 2mm. de apertura palpebral) de la conjuntiva y de la aponeurosis del elevador del párpado, se reseca casi en su totalidad, no requiere sutura. Se sienta al paciente y se le solicita que mire hacia adelante para evaluar la posición del párpado. Como se mencionó esta técnica puede ser suficiente en pacientes con retracciones mínimas, si el resultado no es adecuado se deben agregar procedimientos adicionales que se tratarán a continuación.
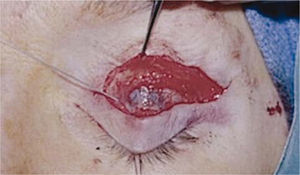
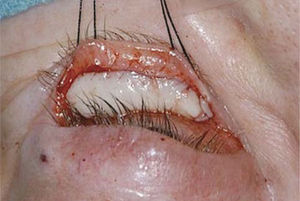
Resección del músculo elevador del párpadoEs una cirugía compleja debido a la hemorragia que se produce durante el procedimiento y a la poca predictibilidad del resultado, lo que lleva a reoperaciones con frecuencia, el resultado estético tiende a ser mejor si se realizado una descompresión orbitaria previamente. La cirugía se realiza bajo anestesia local y sedación y para ello se marca antes de la infiltración con anestesia local el pliegue palpebral, se escinde la piel y el músculo orbicular, se identifica el Septum orbitario y se abre, luego se identifica la grasa preaponeurótica la que se diseca de la aponeurosis del elevador del párpado. Se libera el elevador del párpado de su inserción en el tarso y adicionalmente se diseca del Músculo de Müller, se sienta al paciente y se evalúa la posición, si persiste la retracción es necesario cortar el cuerno lateral del elevador que corresponde a la inserción de este en la órbita, nuevamente se evalúa la altura y si aún no es suficiente puede que sea necesario extirpar el músculo de Müller si no se ha hecho previamente y liberar la conjuntiva (Figuras 6, 7A y 7B). En algunos casos puede que sea necesario reinsertar la aponeurosis del elevador del párpado para dar un contorno más natural al párpado superior, finalmente se sutura la piel. Otra técnica quirúrgica que ha estado tomando fuerza en el último tiempo es realizar una blefarotomía de espesor total del párpado en la que se deja un pequeño puente de conjuntiva y músculo de Müller para evitar sobre-corrección y mantener un contorno palpebral adecuado, para finalizar se cierra la piel con múltiples suturas separadas para evitar fístulas (Figura 8).
Adicionalmente se puede realizar una blefaroplastía superior, pero esta debe ser muy conservadora para evitar exposición corneal.
Corrección de la retracción palpebral del párpado inferiorLa retracción palpebral inferior habitualmente es menos marcada que en el párpado superior, sin embargo esta puede ser severa en casos de exoftalmo o post cirugía de estrabismo en la que al retroceder el recto inferior puede generar una mayor retracción palpebral debido a las conexiones que existen entre el párpado y los músculos extraoculares.
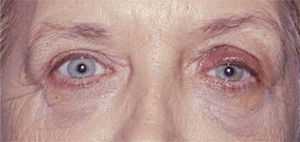
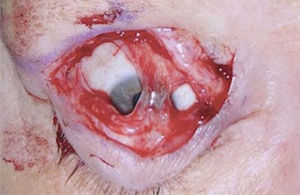
En muchos paciente basta con resecar el retractor del párpado inferior que es una estructura equivalente en función al elevador del párpado superior, pero con una función inversa que consiste en permitir que el párpado inferior descienda cuando se mira hacia debajo de manera tal que no interfiera con la visión. La técnica quirúrgica consiste en realizar una incisión por vía conjuntival en el borde inferior del tarso y disecar el retractor del párpado inferior, que es una estructura principalmente aponeurótica, de la conjuntiva, no requiere sutura y como se mencionó habitualmente es suficiente con este procedimiento, además puede asociarse a una blefaroplastía transconjuntival inferior con lo que mejora considerablemente el aspecto estético del paciente en casos de herniación grasa. En casos de retracción mayor pude ser necesario la colocación de un injerto en el párpado inferior el que puede ser de cartílago auricular o tabique nasal, mi elección personal es mucosa del paladar duro que puede ser suturada directamente al borde inferior del tarso y a la conjuntiva dando soporte al párpado y permitiendo cubrir la zona expuesta de la córnea (Figuras 9 y 10).
El manejo quirúrgico de la Enfermedad de Graves es complejo desde varios puntos de vista, debemos considerar que con mucho mayor frecuencia afecta a mujeres en edad media de la vida y las complicaciones funcionales y estéticas que es capaz de producir pueden ser muy severas, además al tener un curso impredecible e independiente de las manifestaciones endocrinas hace aún más difícil su tratamiento. A esto se suma que la mayoría de los tratamientos quirúrgicos deben hacerse en la fase de inactividad por lo que el tiempo de espera para resolver las secuelas de la enfermedad pueden ser como en la mayoría de los casos muy largos. En términos generales demoramos aproximadamente dos años en rehabilitar una paciente que ha requerido cirugía de descompresión orbitaria, estrabismo y cirugía palpebral (Figuras 11A y 11B).
El autor declara no tener conflictos de interés, en relación a este artículo.